BENZENA DAN TURUNANNYA
- dyfisani
- Dec 7, 2016
- 4 min read
RUMUS STRUKTUR BENZENA
Benzena pertama kali diisolasi pada tahun 1825 oleh Michael Faraday dari residu minyak yang tertimbun dalam pipa induk gas di London dan memberi nama hidrogen bikarburet. Tahun 1833, Eilhard Mitscherlich seorang ilmuwan Jerman berhasil membuat benzena melalui distilasi asam benzoat dan kapur.

Mitscherlich menyebut senyawa tersebut sebagai benzin.
Berdasarkan hasil penelitian, benzena memiliki rumus kimia C6H6. Rumus tersebut memberikan misteri karena tidak sesuai dengan kesepakatan ilmuwan bahwa atom C dapat mengikat 4 atom, dan atom H dapat mengikat satu atom. Setelah 40 tahun, Friedrich August Kekule mengusulkan agar struktur benzena berupa cincin heksagonal, seperti pada gambar berikut :

Struktur benzena yang diusukan Kekule tidak mengandung ikatan rangkap karena benzena tidak bereaksi seperti halnya senyawa hidrokarbon yang memiliki ikatan rangkap. Struktur ini masih menimbulkan masalah karena atom C tidak sesuai dengan asas, dimana seharusnya mengikat 4 atom.
Pada 1872, Kekule mengusulkan perubahan struktur benzena. Menurut Kekule, benzena mengandung tiga ikatan tunggal dan tiga ikatan rangkap yang posisinya berselang-seling.

Berdasarkan hasil penelitian, diketahui bahwa setiap atom C pada cincin benzena memiliki sifat yang sama. Hal ini ditentukan setelah para ilmuwan mengetahui bahwa semua ikatan antaratom C memiliki panjang yang sama, yakni 140 pm (pikometer). Oleh karena semua atom C memiliki fungsi yang sama, ikatan rangkap senantiasa berubah- ubah.

Tanda panah dua arah menunjukkan bahwa benzena mengalami resonansi.
TATA NAMA BENZENA
Benzena dapat mengalami reaksi substitusi membentuk turunan benzena. Atom H pada rantai benzena dapat disubstitusi oleh atom atau molekul lainnya. Berdasarkan jumlah atom H yang disubstitusi, senyawa turunan benzena dapat dikelompokkan menjadi tiga, yaitu :
Benzena monosubstituen
Dalam sistem penamaan IUPAC, cincin benzena dianggap sebagai induk. Penamaan diawali dengan nama gugus diikitu nama benzena. Selain nama IUPAC, turunan benzena juga memiliki nama lain yang lazim digunakan (trivial), seperti ditunjukkan pada tabel berikut.

Benzena disubstituen
Jika dua atom H diganti dengan gugus lain, penaman turunan benzena menggunakan , , atau . Awalan orto untuk menyatakan posisi substituen yang berdekatan (tidak dibatasi atom C), meta (m) artinya kedua gugus substituen terpisah oleh satu atom C, dan para (p) artinya kedua gugus substituen terpisah oleh dua atom C atau kedua gugus berseberangan.

Gugus –COOH sebagai substituen utama(rantai utama menjadi asam benzoat), karena –COOH lebih prioritas dibandingkan –NO2. Berikut urutan prioritas gugus, dari yang lebih prioritas hingga kurang prioritas.
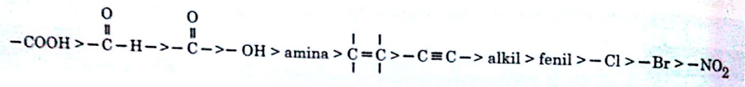
Benzena polisubstituen
Jika terdapat tiga substituen atau lebih, sistem tidak dapat diterapkan, sehingga digunakan bilangan.seperti dalam penomoran senyawa organik rantai lurus, sehingga nomor-nomor gugus prioritas bernomor serendah mungkin. Substituen utama pada cincin diberi nomor 1.

SIFAT-SIFAT BENZENA (SIFAT FISIK DAN KIMIA)
Sifat fisik
Benzena mudah meguap, memiliki bau yang khas, dan tidak larut dalam air, tetapi larut dalam pelarut organik. Senyawa yang larut dalam benzena mudah dikeringkan dengan mendistilasi azeotrop tersebut.
Titik leleh tertinggi merupakan sifat khas benzena p–substitusi; suatu p–isomer lebih simetris dan dapat membentuk kisi kristal yang lebih teratur dan lebih kuat dalam keadaan padat daripada o– dan m–isomer yang kurang simetris.
Sifat kimia
Merupakan senyawa nonpolar.
Benzena tidak begitu reaktif tetapi mudah terbakar dengan banyak jelaga.
Benzena lebih mudah mengalami substitusi daripada adisi.
REAKSI SUBSTITUSI PERTAMA PADA BENZENA
Halogenasi
Pereaksi yang digunakan adalah gas bromin,klorin, dan iodnin dengan katalis besi (III) halida.

Nitrasi
Benzena bereaksi dengan asam nitrat pekat dengan katalis asam sulfat pekat menghasilkan nitrobenzena.

Alkilasi
Pereaksi yang digunakan adalah alkil halida dengan katalisator aluminium klorida.

Sulfonasi
Pereaksi yang digunakan adalah asam sulfat berasap pada suhu 40 derajat celcius.

Asilasi
Pereaksi yang digunakan adalah halida asam, seperti asetil klorida, dan propanoil klorida dengan katalisator aluminium klorida.

PENGARAH ORTO, META, DAN PARA
Benzena yang sudah tersubstitusi ada yang lebih reaktif daripada benzena, tetapi ada juga yang kurang reaktif. Selain itu,benzena tersubstitusi dapat mengalami substitusi lebih lanjut. Substituen yang ada menentukan arah substituen berikutnya

KEGUNAAN SENYAWA BENZENA DAN TURUNANNYA
Benzena, digunakan sebagai pelarut, bahan baku dalam pembuatan plastik, detergen, bahan bakar, dan lain-lain. Benzena bersifat karsinogenik.
Aspirin, disebut juga asetilasetat, bersifat analgesik, antipiretik, antiradang, dan antikoagulan. Karena sifat-sifat tersebut aspirin biasa digunakans sebagai obat sakit gigi dan obat pusing.
Anilina, biasa dikenal sebagai fenilamina atau aminobenzena. Anilina banyak digunakan sebagai zat warna, bahan baku pembuatan obat. Penggunaan yang berlebihan dapat mengakibatkan mual, muntah-muntah, pusing, dan sakit kepala.
Klorobenzena, banyak digunakan dalam pembuatan pestisida, seperti DDT yang penggunaannya telah dilarang.
Asam benzoat, sebagai pengawet makanan.
Nitrobenzena, dapat digunakan sebagai pelarur, produksi semir, dan senyawa insulator.
Parasetamol atau asetaminofen adalah zat analgesik dan antipiretik yang sering digunakan untuk mengobati pusing dan sakit kepala. Mengkonsumsi parasetamol secara berlebihan dapat menyebabkan gangguan kesehatan.
Fenol, memiliki sifat antiseptik sehingga digunakan untuk mensterilkan alat-alat dalam pembedahan. Selain itu juga digunakan dalam pembuatan obat, resin sintetik, dan polimer. Fenol dapat menyebabkan iritasi pada kulit.
Asam salisilat, dapat bersifat racun apabila digunakan dalam jumlah besar. Dalam jumlah sedikit dapat digunakan sebagai pengawet makanan dan antiseptik pasta gigi.
TNT (Trinitrotoluena), bersifat mudah meledak sehingga digunakan sebagai bahan peledak untuk kepentingan militer dan pertambangan.
DAFTAR PUSTAKA
Justiana, Sandri., dan Muchtaridi. 2009. Chemistry 3 (bilingual). Jakarta:Yudhistira.
.2015. Kimia 3. Jakarta : Yudhistira.
Purba, Michael. 2013.Kimia untuk SMA Kelas XII. Jakarta : Erlangga.
Rahayu, Iman. 2009. Praktis Belajar Kimia untuk Kelas XII Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.









Comments